Cientistas têm pesquisado células-tronco há quase 40 anos
Quais as terapias clínicas parecem promissoras? Há algum tratamento aprovado pelo FDA (Food and Drug Administrations, órgão regulatório estadunidense similar à Anvisa do Brasil)?
Qual é a história das clínicas de células-tronco semi-legais surgindo em todo os Estados Unidos?
Essa matéria foi traduzida pela Retina Brasil. A página original está em constante atualização. Para acessar o original clique aqui.
Autor: Kevin Curran PhD
Introdução às células-tronco
A biologia das células-tronco é um campo fascinante da ciência. O campo combina o desenvolvimento tradicional da biologia, a genética de ponta e uma visão inebriante de novos órgãos gerados com células-tronco.
Depois da faculdade, eu fui imediatamente atraído para esse universo. Passei os sete anos seguintes trabalhando como cientista de células-tronco na UC San Francisco e na Universidade de Washington. Durante meu tempo no laboratório, ganhei um respeito saudável pela complexidade do assunto. Eu ainda reconheço o incrível potencial das células-tronco, mas eu também aprecio os desafios inerentes neste mundo…
- A genética do desenvolvimento celular é intrincada e complicada.
- Resultados bem-sucedidos, observados em animais de laboratório (ou seja, camundongos), nem sempre se reproduzem em pacientes humanos.
- Células-tronco transplantadas nem sempre funcionam da maneira correta. Às vezes, elas se desenvolvem em células erradas.
- Nosso sistema imunológico freqüentemente rejeita células-tronco recém-transplantadas.
Em 2019, as únicas terapias baseadas em células-tronco, aprovadas pelo FDA nos Estados Unidos, eram as terapias com sangue do cordão umbilical. Essas terapias do sangue do cordão umbilical são atualmente limitadas ao tratamento de pacientes com distúrbios sanguíneos. Além disso, Europa, Japão e Coréia do Sul tiveram apenas poucos produtos baseados em células-tronco aprovados.
A ciência leva tempo, mas acho justo afirmar que as terapias com células-tronco aprovadas demoraram a aparecer.
Em contraste, as clínicas de células-tronco semi- legais surgiram rapidamente em todos os Estados Unidos. Na última contagem, 570 clínicas de células-tronco estão oferecendo terapias não aprovadas pelo FDA nos EUA.
O que exatamente essas clínicas estão vendendo? No final de 2017, o FDA alegou que acabaria reprimindo as clínicas de células-tronco ilegais, mas esperariam três anos para iniciar a fiscalização. Por que três anos?
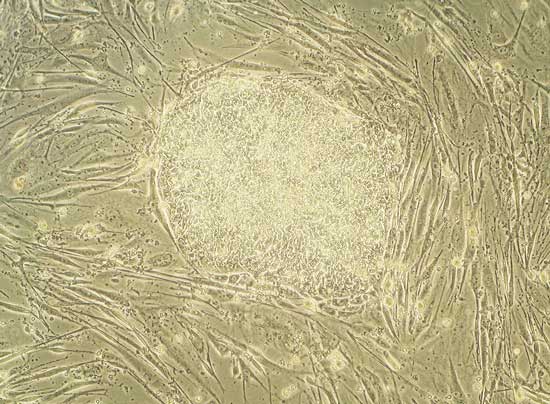
O que são células-tronco e por que elas são especiais?
As células-tronco são um conjunto notável de células que existem em muitos tecidos do corpo humano.
As células-tronco são famosas por sua capacidade de se desenvolver na maioria das distintas células do nosso corpo.
Essas células podem reconhecer lesões em nosso corpo e, em seguida, repovoar o tecido danificado com um novo suprimento de células especializadas. Dessa maneira, as células-tronco trabalham duro para nos manter saudáveis durante toda a nossa vida. Eles podem atuar como um sistema de reparo interno. Em alguns dos nossos órgãos, como o intestino ou a medula óssea, as células-tronco enviam regularmente células de reposição para reparar o tecido desgastado.
Outra característica definidora das células-tronco é sua capacidade de se renovar por longos períodos de tempo. Células-tronco podem ficar escondidas em nosso organismo. Eles ficam em repouso e dividem-se, mantendo uma população discreta e saudável de células. Durante este estado de latência, eles permanecem não diferenciadas. Não diferenciada significa que elas ainda não se desenvolveram em células especializadas. Essas células-tronco em latência estão à espera de um sinal do nosso organismo. Assim que receberem o sinal correto, essas células-tronco dividir-se-ão e formarão o tipo de célula especializada necessária. Pode ser uma célula cerebral, uma célula muscular, uma célula da pele, ou qualquer célula que seja necessária.
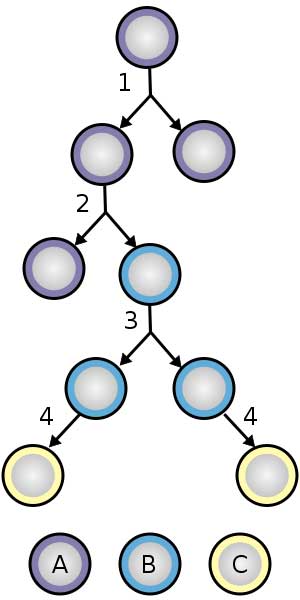
A imagem da divisão de células-tronco à direita (no caso será abaixo) ilustra todas as principais características do desenvolvimento de células-tronco. Ao acompanhar essas divisões celulares, você vê como as células-tronco podem dividir-se indefinidamente e permanecer como células-tronco não-diferenciadas (1), ou podem responder aos sinais de nosso organismo e percorrer um determinado caminho de desenvolvimento (2,3). A maioria das vias de desenvolvimento acabará por diferenciar a célula-tronco em um tipo específico de célula (4).
Em resumo, as células-tronco nos mantêm saudáveis, fornecendo ao nosso corpo células frescas durante toda a vida.
Se isso for entendido, é fácil compreender porquê os cientistas estão trabalhando tanto para usar células-tronco no tratamento de doenças humanas.
Uma vez que aprendermos a manipular eficazmente as células-tronco, poderemos direcionar suas habilidades regenerativas ao tecido ou órgão degenerado de um paciente.
Antes de entrarmos nos últimos avanços, primeiro vamos nos orientar com um breve histórico de pesquisas com células-tronco.
Profunda história da terapia com células-tronco
As células-tronco têm desfrutado de uma história colorida – repleta de política, debates éticos, alegações falsas, controvérsia e muita propaganda. Vamos traçar nosso estudo passando por alguns dos principais eventos.
Voltemos à descoberta da teoria celular.
Para colocar nosso conhecimento de células-tronco no contexto apropriado, devemos primeiro analisar um grupo de médicos alemães muito brilhantes. Em 1838, Theodor Schwann e Matthias Schleiden propuseram a teoria celular da vida. Schleiden e Schwann foram os primeiros cientistas a reconhecer que toda a vida é construída a partir de células.
Alguns anos depois, Rudolf Virchow construiu a teoria das células de Schleiden e Schwann propondo que as células se dividem para criar outras células. Isso pode parecer óbvio para nós agora, mas certamente não era óbvio naquela época.
Antes de meados de 1800, as pessoas pensavam que as células doentes poderiam aparecer espontaneamente no corpo de uma pessoa doente. Virchow propôs que as células doentes surgiam de uma versão defeituosa de uma célula normal.
Em 1855, Virchow resumiu sua contribuição à biologia com a concisa frase: Omnis cellula e cellula. Traduzido – Toda célula vem de outras células.
O campo da biologia sobre células-tronco repousa sobre essa estrutura conceitual.
Como surgiu a primeira terapia com células-tronco?
Curiosamente, a descoberta de células-tronco surgiu de um incidente relacionado ao bombardeio do Japão em 1945. Quando as bombas atômicas caíram sobre Hiroshima e Nagasaki, milhares de pessoas pereceram instantaneamente. Para agravar a situação, os sobreviventes japoneses desses ataques brutais começaram a morrer nos anos seguintes a 1945. Uma enorme quantidade de radiação atômica foi liberada quando as bombas explodiram. Essa radiação atômica não matou os japoneses imediatamente, mas destruiu as células-tronco que viviam em suas medulas ósseas. Agora, sabemos que essas células-tronco da medula óssea desenvolvem-se em todas as células do nosso sangue e sistema imunológico. Essas células-tronco são chamadas células-tronco hematopoiéticas.
Em 1956, a comunidade científica descobriu a relação entre a medula óssea, células-tronco e a morte dos sobreviventes japoneses. Quando os sobreviventes japoneses perderam suas células-tronco da medula óssea, seus corpos perderam a capacidade de criar novas células do sistema imunológico. Sem glóbulos brancos, os sobreviventes morreram assim que uma infecção entrou em seu corpo. Eles simplesmente não tinham sistema imunológico para enfrentar até mesmo uma infecção leve.
Este conhecimento levou ao primeiro transplante de medula óssea em 1968.
Ao transplantar a medula óssea de uma pessoa para outra, você está trazendo células-tronco frescas para o corpo de um paciente doente. Essas células-tronco hematopoéticas podem, então, proliferar e suprir o indivíduo doente com diferentes tipos de células sanguíneas e células do sistema imunológico. O primeiro transplante de medula óssea tratou com sucesso dois irmãos que sofriam de SCID, ou imunodeficiência combinada severa.
Caminhando para a era moderna
Em 1978, uma população separada de células-tronco foi encontrada no sangue do cordão umbilical. O sangue do cordão umbilical é o sangue que sobra no cordão e na placenta após o parto. As células-tronco do sangue do cordão umbilical funcionam de maneira semelhante às células-tronco da medula óssea.
Em 1981, MJ Evans e MH Kaufman publicaram um artigo de referência na revista Nature que demonstrou como as células-tronco embrionárias de camundongos poderiam ser isoladas e depois cultivadas indefinidamente em uma placa de Petri em um laboratório. Essas células-tronco imortais mostraram comportamento celular normal (cariótipo normal) e mantiveram sua capacidade de se desenvolver em vários tipos de células. Esse artigo foi significativo, porque mostrou que as células-tronco poderiam ser estudadas e manipuladas em um ambiente de laboratório.
Neste ponto, o campo de pesquisa de células-tronco começou a crescer. Na década de 1990, os cientistas estavam aprendendo a manipular tecidos de camundongos adultos para produzir diferentes tipos de células. Por exemplo, os cientistas poderiam isolar as células da medula óssea em um frasco e, em seguida, ajustar as condições do meio para produzir células nervosas ou hepáticas. O meio é o que chamamos de caldo rico em nutrientes que alimentam as células-tronco à medida que crescem em laboratório. Controlar a direção do desenvolvimento de células-tronco geralmente significa adicionar ou subtrair sinais biológicos (proteínas ou pequenos produtos químicos) do meio celular.
Em 1998, pesquisadores da Universidade de Wisconsin isolaram células do centro de embriões humanos. Essas células são conhecidas como células-tronco embrionárias. Elas são o santo graal das populações de células-tronco, porque elas mantêm a capacidade de se tornar todos os tipos de células do corpo humano. Em contraste, as células-tronco da medula óssea (células-tronco hematopoiéticas) só podem se diferenciar em células do sangue e células do sistema imunológico.
Também em 1998, o trabalho de Janet Rossant, uma bióloga do desenvolvimento, ajudou a levar à descoberta das células-tronco trofoblásticas. A linhagem de células trofoblásticas é fundamental para a sobrevivência de embriões de mamíferos no útero. Desde a descoberta do trofoblasto, os cientistas puderam usar essas células para pesquisar anormalidades congênitas nos vasos sangüíneos e no coração.
Governo dos EUA restringe pesquisa com células-tronco embrionárias humanas
Cientistas de células-tronco rapidamente ficaram muito intrigados com essas células-tronco embrionárias humanas. Essas células ofereceram aos cientistas uma chance de aprender como as células-tronco humanas podem ou permanecer não-diferenciadas, ou serem empurradas para diferentes caminhos de desenvolvimento. No entanto, havia um problema. Células-tronco embrionárias humanas (hESC) eram freqüentemente coletadas de fetos remanescentes de clínicas de fertilização in vitro. A fertilização in vitro gera múltiplos embriões. Muitos deles não serão implantados em mulheres. Com consentimento adequado, os embriões não implantados podem ser doados para pesquisa científicas em células-tronco. Isso pode parecer inócuo o suficiente, contudo, a palavra embrião é polêmica nos Estados Unidos. Setores da direita pró-vida e da direita religiosa estavam desconfortáveis com qualquer manipulação de embriões humanos, mesmo que o embrião estivesse destinado ao descarte. Não ajudou que alguns pesquisadores coletasem seus embriões descartados de clínicas de aborto.
Terapias com células-tronco são legais nos EUA?
No final dos anos 90, a pesquisa com células-tronco nos EUA estava se desenvolvendo e ganhando importância. Coube ao presidente George W. Bush analisar a questão das células-tronco embrionárias humanas. Por um lado, o governo queria apoiar a ciência de ponta, mas, por outro lado, os políticos não queriam endossar o uso de embriões humanos. Em fevereiro de 2001, George W. Bush solicitou uma revisão das diretrizes do NIH. Em agosto de 2001, Bush tomou sua decisão e promulgou uma política para limitar o financiamento de pesquisas com células-tronco embrionárias a 19 linhas de células-tronco embrionárias humanas pré-existentes. Esse foi um grande revés para a comunidade de pesquisa com células-tronco.
Felizmente, o financiamento a nível estadual é uma possibilidade. A Califórnia assumiu a liderança no financiamento estadual da pesquisa de células-tronco. Em 2004, os eleitores da Califórnia aprovaram US $ 3 bilhões em financiamento para pesquisas com células-tronco. Eu me lembro desse momento vividamente. Em 2004, eu era um cientista de células-tronco embrionárias no Laboratório Conklin da UCSF. Aquele foi um momento emocionante. O financiamento a nível estadual foi um fôlego de vida em pesquisas sobre células-tronco embrionárias humanas.
Ao longo dos anos 2000, ficou claro que a restrição federal à pesquisa com células-tronco embrionárias humanas era equivocada e que não cabia às funções do governo federal. Em 9 de março de 2009, o presidente Barack Obama emitiu uma ordem executiva que removeu muitas dessas restrições federais. Esse foi um bom momento para a comunidade de células-tronco. No entanto, a infeliz realidade é que qualquer pesquisa envolvendo células-tronco envolvendo embriões humanos sempre será politicamente carregada. Eu não ficaria surpreso se o pêndulo voltar a regulamentações mais rigorosas no futuro.
Fraude científica abala a comunidade internacional de células-tronco
Devemos ter um momento para refletir sobre um infeliz incidente que se transformou em um enorme escândalo internacional. Em 2005, um veterinário e cientista coreano chamado Woo Suk Hwang publicou um artigo inovador na Science. Hwang afirmou que seu grupo na Universidade Nacional de Seul havia clonado com sucesso embriões humanos. Hwang realizou esse feito notável por meio da transferência nuclear de células somáticas (SCNT). Isso significa que você coleta óvulos humanos, retira o núcleo do óvulo e insere um núcleo adulto de outro humano adulto. Você então permite que o óvulo se transforme em um embrião (um novo humano). Em teoria, o novo embrião é um clone de quem doou o núcleo adulto. A comunidade científica já sabia que a clonagem era possível com outros animais (ovelhas, camundongos, vacas, etc.) No entanto, ninguém conseguira clonar um humano. Hwang alegou ter realizado a clonagem humana e também alegou ter derivado células-tronco embrionárias desse embrião clonado. A comunidade internacional ficou muito impressionada… por cerca de um ano.
Em 2006, erros e inconsistências começaram a surgir na documentação científica de Hwang. Os colegas de Hwang da Universidade Nacional de Seul iniciaram uma investigação completa de todas as suas alegações publicadas. Após um exame mais minucioso, tudo desmoronou. Em 10 de janeiro de 2006, a Universidade divulgou uma declaração afirmando que todos os dados de Hwang foram fabricados.
Derivando células-tronco de um embrião humano clonado
Infelizmente, as falsas alegações de Hwang obscurecem a integridade de toda a comunidade de células-tronco. A técnica de transferência nuclear de células somáticas era legítima, mas simplesmente não estava pronta para o momento. Clonagem humana à parte, há um imenso valor na utilização do SCNT para gerar células-tronco embrionárias que combinam perfeitamente com um adulto humano. O ser humano que doa o núcleo da célula adulta ao procedimento SCNT gerará uma reserva particular de células-tronco embrionárias humanas, que podem ser armazenadas em um freezer por décadas. Em teoria, se surgir um cenário, mais tarde na vida, em que esse adulto precise de algum tecido substituto, o hESC pode ser descongelado e diferenciado no tipo de célula desejado e depois transplantado para o mesmo adulto. Como a genética é a mesma, não deve haver problema com a Doença do enxerto contra o hospedeiro (GVHD), também conhecida como rejeição imunológica das células transplantadas de outra pessoa.
Os cientistas levaram outros 5-7 anos para trabalhar os detalhes do SCNT humano. Em 2013, uma equipe de cientistas liderada por Shoukhrat Mitalipov publicou o primeiro relatório legítimo de clonagem humana. Mitalipov também retirou células-tronco embrionárias dos embriões humanos clonados. Seus resultados agora tem sido replicados por vários outros laboratórios. Então, é seguro dizer que descobrimos como clonar embriões humanos. No entanto, ainda é cedo demais para considerar esse procedimento como uma ferramenta para um adulto gerar sua própria reserva de hESC (com valor terapêutico). Principalmente, porque os cientistas ainda estão descobrindo a melhor forma de realizar terapias com hESC.
Deve ser notado que em todos esses experimentos, os embriões humanos clonados nunca foram implantados em mulheres. Na maioria dos países, é ilegal implantar um embrião humano clonado em uma mulher e depois levar esse bebê clonado ao nascimento. Se essa etapa final for completada com sucesso, teríamos clones humanos andando pela terra. Até onde sei, não há organização ou governo que esteja perseguindo esse objetivo. É claro que ninguém pode ter certeza absoluta do que acontece em laboratórios silenciosos e privados. Se alguém tiver alguma informação sobre laboratórios privados que estejam clonando embriões humanos e tentando levá-los à vida, entre em contato comigo aqui.
Pesquisas atuais com células-tronco
Pesquisas atuais com células-tronco
A pesquisa com células-tronco está avançando em muitas direções diferentes. O corpo humano é uma fonte de múltiplos tipos de células-tronco. Muitos desses tipos de células estão sendo explorados por seu potencial terapêutico (células-tronco neurais, células-tronco mesenquimais, células-tronco adiposas, células-tronco embrionárias humanas, etc.)
Abaixo, vou mencionar alguns dos avanços mais promissores nesse universo de células-tronco. Organizei as categorias de pesquisas com células-tronco ou pelo tecido/órgão que os cientistas estão tentando regenerar, ou pelo tipo de célula-tronco que está sendo buscada por seu valor terapêutico.
Deve-se notar que o debate político em relação às células-tronco (descrito acima) refere-se apenas às células-tronco embrionárias humanas. A maioria dos ensaios clínicos e tratamentos descritos abaixo envolvem células-tronco adultas, e não células-tronco embrionárias. Células-tronco embrionárias são removidas de um embrião humano quando esse embrião tem apenas alguns dias de vida. Em contraste, as células-tronco adultas existem em muitas partes de um corpo humano adulto. Um clínico pode extrair essas células com bastante facilidade sem ferir o indivíduo. Não há questões éticas sobre o uso de células-tronco adultas.
Ok, primeiro vamos revisar algumas terminologias. Tratamentos com células-tronco são classificados como: autólogos, alogênicos ou xenogênicos.
Autólogos: as células-tronco são obtidas de um indivíduo, processadas de alguma forma e depois transplantadas de volta para o mesmo indivíduo.
Alogênico: as células-tronco são obtidas de um indivíduo, processadas de alguma forma e depois transplantadas para um indivíduo diferente da mesma espécie. Por exemplo, a medula óssea pode ser removida de uma pessoa e transplantada para outra pessoa.
Xenogênico: as células-tronco são removidas de uma espécie, processadas de alguma forma e depois transplantadas para um indivíduo de outra espécie. Por exemplo, as células-tronco podem ser removidas de uma vaca e usadas para tratar um humano.
Regeneração de tecidos do coração
Um grupo de cientistas está focado no uso de células-tronco para reparar tecidos cardíacos danificados. Depois de um ataque cardíaco (ou infarto do miocárdio), uma seção do coração é freqüentemente afetada, ficando com uma cicatriz. Isso significa que uma região das células cardíacas (miócitos cardíacos) não é mais funcional e não bate mais em sincronia com o compasso natural do coração. Em essência, a região da cicatriz se torna um peso morto para o bombeamento do coração. Transplantes de células-tronco realizados em animais de laboratório sugerem que o tecido cardíaco danificado pode ser reparado com células-tronco. Em fevereiro de 2012, pesquisadores do Cedar-Sinai Medical Center e John Hopkins publicaram os resultados de testes clínicos mostrando que essa estratégia também poderia funcionar em humanos. Células-tronco adultas foram extraídas do coração de um paciente após esse paciente ter sofrido um ataque cardíaco. Essas células-tronco foram cultivadas e tratadas em laboratório e depois transplantadas de volta para a área danificada no coração do paciente. Esse tratamento diminui as cicatrizes, levou ao crescimento do tecido cardíaco e retornou alguma funcionalidade para o órgão danificado. Esses resultados foram considerados como a primeira demonstração de regeneração terapêutica baseada em células-tronco em humanos.
Até 2019, não há tratamentos com células-tronco para a regeneração do coração aprovados pelo FDA.
Regeneração de tecidos dos olhos
Em 15 de fevereiro de 2015, os resultados de um ensaio clínico aprovado pelo FDA demonstraram a capacidade das células-tronco de reduzir a cegueira.
A Degeneração Macular Relacionada à Idade (DMRI) é uma das principais causas de cegueira nos países desenvolvidos. Essa doença ocular causa a degeneração do tecido crítico dos olhos, chamado epitélio pigmentar da retina (EPR). Uma vez que o EPR começa a se desfazer, você pode perder suas células foto-receptoras e, em última análise, sua visão se reduz. O tecido ocular é uma parte ideal do corpo para realizar transplantes de células-tronco por dois motivos. 1) O olho é uma parte fácil do corpo para acessar. 2) O tecido ocular é imuno-privilegiado, o que significa que é menos provável que o tecido ocular rejeite as células transplantadas.
Um transplante de células-tronco muitas vezes provoca uma forte resposta do sistema imunológico, que precisa ser combatida com tratamento imunossupressor, a fim de evitar a rejeição imunológica. Mas, como o espaço sub-retiniano é sancionado pela barreira hemato-ocular, o tecido de EPR tem maior tolerância a antígenos estranhos ou células não histocompatíveis (como células-tronco tratadas em laboratório).
Essa é a maneira chique de dizer que o tecido dos olhos tem menor probabilidade de rejeitar as células-tronco transplantadas.
Em 2015, Steven Schwartz e seus colegas trataram 18 pacientes que sofriam de DMRI. Células-tronco embrionárias humanas foram transplantadas para os olhos desses pacientes cegos. Esse estudo de Schwartz, publicado no The Lancet, revela que 10 dos olhos tratados responderam com melhorias na acuidade visual.
Atualmente, não há tratamento com células-tronco aprovadas pelo FDA para doenças oculares.
No entanto, em fevereiro de 2015, a Comissão Europeia (EMA) aprovou o Holocar para uso em casos de cegueira causada por queimadura.
Anualmente, apenas cerca de 1.000 pessoas na Europa serão elegíveis para o tratamento com Holocar. Um candidato para esse tratamento incluiria vítimas de queimaduras que ficaram cegas, mas cujos olhos não foram completamente destruídos.
Graziella Pellegrini, uma cientista italiana, foi a principal condutora dessa terapia oftalmológica. Graziella tem, há 25 anos, perseguido obstinadamente a regeneração por células-tronco. Ela liderou sua equipe em ensaios clínicos, mostrando que as células da córnea danificadas poderiam ser substituídas por células-tronco.
“Eu vi pacientes que começaram a ver novamente depois de 20 anos de cegueira: como eu poderia parar?” Graziella Pellegrini
O grupo de Graziella Pellegrini formou uma empresa, chamada Holostem, para ajudar a converter esses resultados clínicos em uma terapia aprovada. Holostem e Chiesi Farmaceutici (Parma, Itália) desenvolveram conjuntamente a terapia Holocar como um produto comercial. Esse tratamento autólogo do Holocar remove células saudáveis da córnea de uma vítima de queimadura com olhos parcialmente danificados. As células da córnea são então cultivadas em um suporte de bioengenharia feito de proteína de fibrina humana modificada. Quando aproximadamente 3.000 células-tronco são geradas na plataforma de fibrina, as células-tronco e seu suporte de fibrina são transplantadas para os globos oculares danificados. Esse transplante é suficiente para semear o crescimento de tecido ocular fresco e funcional da córnea.
Esperamos ver esse tratamento Holocar aprovado nos EUA em breve …
Regeneração de tecidos da pele
A regeneração da pele é um esforço complicado. Há algum tempo, cientistas e engenheiros vêm aprimorando os projetos experimentais, tentando gerar adequadamente o novo tecido da pele e enxertá-lo no corpo do paciente. Um artigo da Nature publicado em novembro de 2017 traz um marco importante nessa nobre busca. Uma equipe de pesquisadores italianos, liderada por Michele De Luca, tratou um jovem que sofria de uma doença de pele horrível chamada JEB, ou epidermólise bolhosa juncional. Pacientes que sofrem de JEB carregam mutação em um gene chamado laminina-332. Em um indivíduo saudável, esse gene codifica uma proteína crucial da membrana basal que permite que as células da pele (queratinócitos aka) funcionem normalmente. Se você carregar uma mutação no gene laminina-332, suas células da pele não se comportarão corretamente. Nesse caso, pesquisadores italianos concentraram seus esforços em um menino alemão de sete anos de idade com um gene laminina-332 mutante. Essa criança tinha perdido 80% de sua pele.
Os cientistas italianos removeram uma pequena porção da pele restante do menino. Eles então isolaram grupos de células-tronco epidérmicas do tecido da pele. Uma vez isoladas em laboratório, eles modificaram geneticamente as células-tronco epidérmicas. Um vírus foi empregado para reintroduzir uma versão saudável do gene laminina-332. Essas células-tronco geneticamente modificadas foram então transformadas em lâminas no laboratório e – quando chegou a hora certa- as lâminas de células de pele foram enxertadas no corpo do menino.
Os cientistas confirmaram que essas células-tronco geneticamente modificadas haviam assumido o trabalho de reparar a pele do menino.
O paciente recebeu alta em fevereiro de 2016. Sua pele está estável e robusta e não apresenta bolhas, coceira ou necessidade de pomadas ou medicamentos.
Isso é realmente incrível. Que presente para o menino! Cientificamente, o artigo combina um progresso excepcional na terapia gênica e no transplante de células-tronco.
Atualmente, não existem terapias para a pele a base de células-tronco aprovadas pelo FDA.
Células-tronco pluripotentes induzidas (iPSC)
Eu estava profundamente na toca do coelho da minha tese de doutorado em 2006. Meu projeto de doutorado tentou identificar os fatores de transcrição que poderiam transformar uma célula-tronco em uma célula diferenciada. Menciono isso porque, em 2006, lembro-me distintamente de nossa reunião de laboratório na manhã de segunda-feira, na qual discutimos pela primeira vez um artigo inovador publicado por Shinya Yamanaka. Trabalhando na Universidade de Kyoto, Yamanaka e seu aluno de graduação Kazutoshi Takahashi, descobriram como reprogramar células adultas de volta a células-tronco pluripotentes. Sua equipe pegou células da pele de um voluntário de meia-idade e tratou as células com apenas 4 genes. Essa reprogramação genética relativamente simples criou uma população de células-tronco a partir de células da pele adulta. Esse foi um achado enorme. A descoberta mostrou que era possível para adultos criar suas próprias células-tronco a partir de suas próprias células da pele. Em teoria, essas células-tronco personalizadas poderiam ser usadas para substituir qualquer tecido em deterioração mais tarde na vida. Por essa realização, Yamanaka recebeu o Prêmio Nobel de Medicina em 2012.
Em entrevista ao NY Times em 2017, Yamanaka descreveu como o iPSC está sendo explorado como uma ferramenta para tratar a degeneração macular. Dr. Takahashi, que trabalha na Riken, removeu células da pele de uma paciente de 70 anos com DMRI. As células da pele foram primeiro reprogramadas para se tornarem células-tronco pluripotentes. Eles foram então encorajados a se tornar células da retina adulta (por meio de ajustes com fatores de sinal). Finalmente, essas células da retina foram transplantadas para os olhos da paciente original com degeneração macular. De acordo com Yamanaka, esta mulher de 70 anos agora vê mais claramente. Yamanaka também reconhece que os tratamentos subseqüentes não foram tão bem sucedidos (mutações de DNA problemáticas surgiram nas iPSCs alteradas).
Yamanaka espera grandes coisas das iPSC no futuro, mas também costuma lembrar ao público que é preciso ser paciente enquanto as aplicações clínicas razoáveis são exploradas.
Atualização de 2019: pesquisadores do NIH publicaram um relatório detalhando como as iPSCs podem trabalhar para substituir os fotorreceptores danificados na DMRI avançada. Esse trabalho foi realizado em modelos de ratos e porcos, mas agora parece pronto para avançar em testes clínicos com humanos. Nesse relatório, células sangüíneas humanas foram removidas de pacientes, essas células foram reprogramadas em células iPSC, e então foram encorajadas a se tornarem células do epitélio pigmentado da retina (EPR). Essas células do EPR foram transplantadas para os olhos de animais com DMRI avançada. Esse procedimento ajudou a restaurar a visão dos animais.
Dez semanas após os remendos de EPR, derivados das iPSC humanas, terem sido implantados nas retinas dos animais, os estudos de imagiologia confirmaram que as células produzidas em laboratório tinham sido integradas à retina do animal.
Os pesquisadores também confirmaram que esse processo não introduziu mutações genéticas no DNA das células reprogramadas.
Atualmente, não há produtos de terapia com células-tronco pluripotentes (iPSC) aprovados pelo FDA.
Células-tronco da medula óssea
Como descrito na seção anterior, os transplantes de medula óssea têm sido realizados nos EUA desde a década de 1960. Nossos ossos são preenchidos com uma população muito fértil de células-tronco da medula óssea, essas podem ser aplicadas para uma variedade de terapias.
A medula óssea é uma excelente fonte de células-tronco CD34 +, também conhecidas como células-tronco hematopoiéticas. Essa famosa classe de células-tronco pode se transformar em todos os glóbulos vermelhos, todos os glóbulos brancos e todas as plaquetas do nosso sistema circulatório. O estroma da medula óssea também contém uma classe separada de células-tronco chamadas células-tronco mesenquimais (MSCs). As MSCs também são multipotentes e podem se desenvolver em células de gordura (adipócitos), em células ósseas (osteoblastos) e em tecido conjuntivo (fibroblastos), condrócitos e miócitos. Infelizmente, a medula óssea parece ser uma fonte relativamente pobre de células-tronco mesenquimais. As MSCs derivadas da medula óssea podem fornecer suporte para a regeneração de tecidos por meio da melhoria do fluxo sanguíneo (revascularização) e do fornecimento de suporte para as células estaminais.
Transplantes de medula óssea são realizados para o tratamento de doenças graves de medula óssea, ou de câncer no sangue. Frequentemente, um paciente com câncer (leucemia ou linfoma) removerá suas próprias células da medula óssea antes de uma dose pesada de quimioterapia. A quimioterapia vai matar muitas células cancerígenas, bem como células sanguíneas e células imunitárias saudáveis. Após a quimioterapia, a medula óssea extraída será reintroduzida nos ossos do paciente com câncer, a fim de repovoar o corpo com sangue fresco e células do sistema imunológico.
Tratamentos de medula óssea geralmente não são regulados pelo FDA. Eu não estou totalmente claro do porquê os tratamentos de medula óssea não serem considerados uma droga pelo FDA, no entanto, outros tratamentos com células-tronco autólogas mencionados abaixo estão sendo atualmente considerados uma droga. Se alguém tiver uma ideia disso, por favor me avise.
Sangue do cordão umbilical
O sangue do cordão é encontrado no sangue que permanece na placenta e no cordão umbilical após o parto. Dentro do sangue do cordão há uma população de células-tronco do cordão umbilical. É importante notar que as células-tronco do sangue do cordão umbilical são uma população restrita de células-tronco, similar às células-tronco hematopoiéticas da medula óssea. Essas células podem se diferenciar em células do sangue e do sistema imunológico e em alguns outros tipos de células.
Há pesquisas em andamento para explorar o uso do sangue do cordão umbilical para tratar diabetes e certos tipos de câncer no sangue. Teoricamente, as célula-tronco do sangue do cordão umbilical podem ser usadas no tratamento de quase 80 doenças, no entanto, não é claro o quão eficaz é o sangue do cordão para esses tratamentos. Clínicas de sangue em todo o paí (EUA) agora tratam, rotineiramente, pacientes com problemas hematológicos (anemia, leucemia, linfoma) com sangue do cordão umbilical para . As funções do sangue do cordão umbilical são semelhantes às células da medula óssea, mas o sangue do cordão umbilical parece ser mais tolerante ao sistema imunológico (ou seja, menor chance de doença crônica do enxerto contra o hospedeiro).
Quando os pais dão à luz uma criança, eles podem ser questionados se gostariam de extrair sangue do cordão umbilical e armazenar as células em um banco de células privadas. Essa é uma decisão difícil. O armazenamento de sangue do cordão umbilical não é barato, mas essas células podem ser úteis algum dia para o seu filho (uso autólogo) ou para um membro da família (uso alogênico). Os pais devem saber – há atualmente uma chance muito baixa de que essas células armazenadas sejam utilizadas. A Academia Americana de Pediatria observa que as chances de usar o sangue do próprio cordão de uma pessoa são de 1 em 200.000. Como as pesquisas para terapias com células-tronco avançam, é possível que essas células sejam utilizadas para tratar uma ampla gama de doenças (Parkinson, autismo, Alzheimer etc.). Mas, por enquanto, não há tratamentos com células-tronco aprovadas para esses problemas.
Apesar da falta de terapias aprovadas, um recente ensaio clínico de Fase 2 da Duke University destacou o benefício do armazenamento do sangue do cordão umbilical. Joanne Kurtzberg e sua equipe clínica trataram 63 crianças diagnosticadas com paralisia cerebral espástica. A equipe de Joanne entregou entre 10 e 50 milhões de células-tronco por quilo de peso corporal, por meio de infusão intravenosa. Essas crianças foram tratadas com células-tronco do próprio sangue do cordão umbilical. Após um ano, ficou determinado que as crianças que receberam 25 milhões de células-tronco / kg de peso corporal mostraram as maiores melhorias na função motora.
Nós estamos encorajados pelos resultados desse estudo, que mostra que infusões adequadamente dosadas de células do sangue do cordão umbilical podem ajudar a diminuir os sintomas em crianças com paralisia cerebral – Joanne Kurtzberg (diretora do Programa de Transplante de Sangue e Medula Pediátrica da Duke).
O FDA aprovou vários tratamentos com sangue do cordão umbilical.
Atualmente, escrevo em 2019, existem 8 diferentes tratamentos de terapia celular aprovados com sangue do cordão umbilical listadas na página do FDA (Allocord, Hemacord, Clevecord, Ducord, HPC, etc.) Esses tratamentos são descritos como ‘transplantes alogênicos de células hematopoéticas apropriadas para pacientes que sofrem de desordem sanguínea, ou desordem celular imunológica’. Alogênico significa que as células-tronco do sangue do cordão coletado podem ser usadas para tratar outras pessoas além do doador (por exemplo, os pais podem ser tratados com o sangue do cordão umbilical do seu filho). Nesse sentido, as terapias com sangue do cordão umbilical poderiam ser pensadas como uma versão não invasiva de um transplante de medula óssea.
Em 2011, a Hemacord foi o primeiro produto de células-tronco aprovado pelo FDA. Fabricado pelo New York Blood Center, o Hemacord é usado para transtornos específicos em pacientes com problemas em seus sistemas de formação de sangue. Em 2013, o nome Hemacord mudou para HPC Cord Blood.
Outro produto com sangue do cordão umbilical, o HPC, é oferecido pela Bloodworks em Seattle. Seu site afirma que eles “coletam 2 xícaras de sangue do cordão umbilical” do cordão umbilical e da placenta após a gravidez. Seu produto de sangue do cordão é usado para tratar várias doenças do sangue.
Tecido do cordão umbilical
O tecido do cordão umbilical humano é semelhante ao sangue do cordão umbilical, no entanto, o tecido do cordão umbilical é derivado do centro carnudo do cordão umbilical. O tecido do cordão umbilical parece ser uma fonte muito rica de células-tronco mesenquimais. Por essa razão, essas células são muitas vezes chamadas de células-tronco mesenquimais derivadas do cordão umbilical (UC-MSCs). Essas células-tronco em particular parecem ter características de alta vitalidade celular, baixa imunogenicidade e alto potencial de sinalização celular (parácrina) para auxiliar em várias formas de reparo tecidual. Este artigo demonstra como as UC-MSCs melhoraram significativamente a sobrevida de camundongos que sofriam de lesão pulmonar aguda. Ensaios clínicos em humanos estão em andamento para determinar se a injeção intravenosa de UC-MSCs pode oferecer alívio dos sintomas para pacientes com esclerose múltipla. Um grupo, liderado por Neil Riordan, já publicou seus resultados da Fase 1/2. Esses resultados preliminares parecem promissores, mas é importante reconhecer que esse estudo clínico de esclerose múltipla foi realizado com um braço único, de rótulo aberto, em um único centro e em apenas 20 pacientes com esclerose múltipla. Eu percebo que isso é jargão de teste clínico, deixe-me decifrar. Não houve grupo controle placebo, tanto o paciente quanto o médico conheciam o tratamento que estavam administrando e isso só foi testado em um pequeno grupo de pacientes dentro de uma clínica de células-tronco no Panamá. Nada disso desacredita os resultados, mas significa que precisamos esperar por ensaios clínicos mais rigorosos para saber com certeza se as células-tronco oferecem tratamento efetivo para pacientes com EM. Você pode assistir a Neil Riordan e Mel Gibson discutindo tratamentos de UC-MSC no vídeo abaixo.
Assista ao vídeo, observe que o vídeo é uma referência do artigo original e está em inglês.
Este vídeo incrivelmente divertido apresenta Joe Rogan e Mel Gibson (sim, aquele Mel Gibson) conversando com o Dr. Neil Riordan sobre tratamentos de UC-MSC realizados no pai de Mel no Panamá.
Atualmente, não há tratamentos aprovados pelo FDA que usem tecido de cordão umbilical humano.
Células-tronco amnióticas
No início de 2007, o Dr. Anthony Atala e seus colegas isolaram um novo tipo de célula-tronco do líquido amniótico. Durante a gravidez, o líquido amniótico pode ser extraído do saco amniótico sem prejudicar os embriões humanos. Alguns cientistas afirmam que as células-tronco encontradas no líquido amniótico têm mais potencial do que as células-tronco encontradas no sangue do cordão umbilical, ou na medula óssea. Mais potencial significa que essas células podem se diferenciar em uma ampla variedade de células. Parece que as células-tronco amnióticas podem se desenvolver em células de todas as três camadas germinativas do desenvolvimento (endoderme, mesoderme, ectoderma). Importante, eles não parecem formar teratomas (um tumor canceroso formado a partir de todos os 3 tecidos germinativos).
Essas características tornam a população de células-tronco amnióticas atrativa para múltiplas aplicações médicas, como a regeneração de órgãos.
O vídeo do TED Talk abaixo apresenta o Dr. Anthony Atala falando sobre a regeneração de órgãos. As células-tronco amnióticas são uma das fontes de células-tronco usadas atualmente para construir tecidos humanos e órgãos humanos.
Assista ao vídeo, observe que o vídeo é uma referência do artigo original e está em inglês.
Em 2009, o primeiro banco de células-tronco amnióticas dos EUA foi inaugurado em Medford, Massachusetts. Esse banco de células preserva e armazena células-tronco de líquido amniótico.
Infelizmente, algumas clínicas de células-tronco têm se precipitado com essas terapias. Duas clínicas de células-tronco na Califórnia receberam uma queixa oficial da FTC (Federal Trade Commission – Comissão Federal de Comércio) por usar propaganda enganosa e falsa para descrever suas terapias com células-tronco. As clínicas trataram pacientes com células-tronco amnióticas derivadas do líquido amniótico de mulheres que tiveram cesárea. As clínicas fazem alegações de saúde ultrajantes e infundadas (por exemplo, curar cegueira, curar todos os órgãos) associadas à terapia com células-tronco.
Atualmente, não existem produtos de terapia com células-tronco amnióticas aprovados pelo FDA.
Células-tronco adiposas (ASCs)
As células-tronco adiposas são uma população de células-tronco que podem ser isoladas da nossa gordura. Por mais estranho que pareça, a gordura em nosso corpo (coxas, barriga, etc.) é uma rica fonte de células-tronco. Essas ASCs são uma forma de células-tronco mesenquimais. Células-tronco da medula óssea, do sangue do cordão umbilical e células-tronco amnióticas também são fontes de células-tronco mesenquimais. Semelhante a outras células-tronco mesenquimais, essas ASCs são multipotentes e podem diferenciar em muitas células humanas (células ósseas, cartilagem, células endoteliais, adipócitos, células musculares, etc.). Há pesquisas em andamento, mas parece que as ASCs produzem um efeito imunossupressor, provavelmente por meio da secreção de vários fatores tróficos. Certas frações de ASCs também podem conter Tregs, uma célula T que pode suprimir nosso sistema imunológico. Por essa razão, as ASC estão sendo consideradas para doenças autoimunes ou distúrbios inflamatórios.
É por isso que há tanto interesse no tratamento de células-tronco adiposas. Em teoria, se a ciência funcionar …
- um médico pode realizar uma lipoaspiração em um paciente
- o tecido adiposo pode ser processado de modo a isolar as células-tronco adiposas
- esses ASCs poderiam ser colocadas a uma parte do corpo do mesmo paciente que está sofrendo de um problema inflamatório
Uma vantagem do tratamento com células-tronco adiposas é que as ASCs podem ser colhidas repetidamente de forma relativamente não invasiva. As ASCs representam um suprimento de células-tronco mesenquimais que podem ser isoladas do tecido adiposo de maneira fácil. Se você está atrás de células-tronco mesenquimais, uma lipoaspiração é logisticamente mais fácil do que a extração de medula óssea, de sangue do cordão umbilical, ou de líquido amniótico.
Muitas organizações estão atualmente promovendo ensaios clínicos com ASCs. Esses testes abrangem uma ampla gama de aplicações, como regeneração de tecidos moles, reparo do tecido esquelético, infarto do miocárdio, questões antiinflamatórias e controle da dor.
Atualmente, não há produtos para tratamento de células-tronco adiposas aprovados pelo FDA.
A Coréia do Sul, no entanto, aprovou um tratamento autólogo de células-tronco derivadas de tecido adiposo em 2012. A Anterogen, uma empresa com sede na Coréia, produziu um produto de células-tronco chamado Cupistem. Cupistem é baseado nas células-tronco mesenquimais encontradas no tecido adiposo. O Cupistem foi aprovado, pela versão sul-coreana do FDA, para o tratamento da fístula de Crohn e para tecidos articulares danificados ou inflamados.
O surgimento de clínicas semi-legais de células-tronco nos Estados Unidos
A ciência das células-tronco está avançando. Como destaquei acima, estamos vendo alguns ensaios clínicos incrivelmente promissores. Mas, até 2019, além do sangue do cordão umbilical, não vimos nenhuma terapia de células-tronco aprovada no mercado dos EUA.
Curiosamente, esse vazio no mercado está sendo preenchido com clínicas de células-tronco quase-legais, realizando procedimentos não aprovados pela FDA com terapias questionáveis.
Na década passada, se você desejasse uma terapia com células-tronco, precisaria se envolver em turismo de células-tronco. O turismo de células-tronco implicava viagens internacionais para a China, México, Índia, Panamá, etc. em busca de um médico que oferecesse tratamento com células-tronco. Atualmente, esse esforço internacional não é mais necessário. Uma pesquisa recente identificou 570 clínicas nos Estados Unidos atualmente vendendo terapias com células-tronco diretamente aos consumidores.
O que essas clínicas de células-tronco estão vendendo?
A maioria dessas clínicas está vendendo tratamentos autólogos. Como mencionado anteriormente, um tratamento autólogo envolve a remoção de células-tronco de uma parte do corpo, o processamento dessas células de alguma forma e o transplante de volta para o mesmo indivíduo. Muitas clínicas estão extraindo gordura e isolando as células-tronco adiposas do tecido adiposo. Nosso tecido adiposo é uma fonte rica de células-tronco. O termo técnico para as células-tronco em nossa gordura são as células-tronco adiposas. De acordo com esse relatório de 2016, 61% dos tratamentos oferecidos pelas clínicas de células-tronco dos EUA são tratamentos com células-tronco adiposas. Outros tratamentos comumente realizados utilizam as células-tronco hematopoéticas encontradas na medula óssea. OK, então as clínicas estão usando principalmente células-tronco da gordura ou da medula óssea …
Quais doenças são tratadas por essas clínicas?
O principal serviço oferecido por essas clínicas é o tratamento de doenças ortopédicas. Essas terapias ortopédicas geralmente envolvem o uso de células-tronco para reduzir problemas nas articulações ou nos tecidos moles. As clínicas afirmam que seus tratamentos ortopédicos com células-tronco podem reduzir a dor e a inflamação. Essas afirmações podem ser verdadeiras ou podem não ser verdadeiras. A ciência ainda é inconclusiva. Clínicas menos escrupulosas prometem antienvelhecimento, aumento do pênis ou tratamento para Parkinson, Esclerose Múltipla, Paralisia Cerebral e danos na medula espinhal. Isto é o que acontece em um ambiente não regulamentado, nada está fora da mesa.
A verdade é que certas injeções de células-tronco podem ser apropriadas para uma ampla gama de doenças, mas cientistas profissionais ainda estão trabalhando para determinar a segurança e a eficácia dos procedimentos.
Ainda não temos certeza de que tipos de células irão se desenvolver a partir das células-tronco, uma vez que elas são transplantadas para certas partes do corpo. Essas células-tronco transplantadas podem formar um tumor cancerígeno … ou um sério problema de rejeição imunológica …
Um consumidor prudente esperaria até que as dúvidas fossem eliminadas.
Por que a FDA não está reprimindo essas clínicas de células-tronco não aprovadas?
Essa é a verdadeira questão. Não é de surpreender que uma comunidade empresarial agressiva e ágil esteja se esforçando para ganhar dinheiro em nome de células-tronco. Isso é o que os mercenários fazem … eles correm. Alguns clientes estão pagando 15K, do bolso, por procedimentos com células-tronco. Quando há demanda, haverá oferta.
No entanto, é surpreendente que o FDA esteja passivamente permitindo que o nicho se desenvolva.
Em novembro de 2017, o FDA divulgou uma Orientação da Indústria revisada sobre clínicas de células-tronco. Essa orientação reforça a definição do que é permitido nessas clínicas. Em essência, o FDA permite que o tecido biológico seja usado apenas na parte do corpo da qual o tecido foi extraído. Além disso, o FDA permite apenas a manipulação mínima do tecido do paciente. Se uma clínica está agindo fora desses parâmetros, ela está vendendo um medicamento e exigirá o licenciamento apropriado.
Por exemplo, não é legal para uma clínica remover o tecido adiposo da coxa de um paciente, isolar as células-tronco adiposas e depois injetar essas células-tronco no cotovelo de uma pessoa com dor nas articulações. Esse procedimento envolve mais do que o processamento mínimo e muda o tecido biológico do local A para o local B. Portanto, esse procedimento é uma violação da nova Orientação da Indústria do FDA.
Ok… mas aqui está a estranha notícia. O FDA está fornecendo a essas clínicas 36 meses para cumprir os regulamentos mais rigorosos. Para aqueles que seguem em casa, 36 meses são três anos. Muitos tratamentos imprudentes e caros podem ser realizados em 3 anos.
Três anos é muito tempo para que clínicas potencialmente não-conformes continuem ganhando massa de pacientes.–Paul Knoepfler
Então, o que o FDA faz?
A resposta curta é. . . Eu não sei exatamente.
Eu ouvi um representante da FDA falar sobre esse assunto em um simpósio médico no final de 2018. O palestrante explicou que o FDA simplesmente não tem orçamento e pessoal suficientes para investigar e responder ao enorme volume de clínicas semi-legais de células-tronco.
No entanto, ao fornecer 3 anos para as clínicas se regulamentarem, o FDA está endossando tacitamente a experimentação humana com vários tratamentos com células-tronco. Talvez o FDA veja esse período de carência como uma oportunidade para deixar o mercado definir quais tratamentos oferecem o melhor valor.
Além disso, muitos desses tratamentos com células-tronco estão ampliando a definição de um medicamento. Se você remover células-tronco do seu corpo, centrifugar as células, tratá-las em um laboratório e depois injetá-las de volta em seu próprio corpo … isso é realmente uma droga biológica? Talvez o FDA esteja em dúvida em termos da melhor forma de categorizar esses tratamentos? Novamente, três anos assistindo essas clínicas operarem poderia ajudar a tomar essa decisão regulatória.
Também deve ser mencionado que, além de emitir novas orientações, o comissário do FDA (Scott Gottlieb) está indo atrás dos criminosos mais notórios no universo de células-tronco. Por exemplo, a FDA enviou uma carta de alerta severa para a Stem Cell Clinic, uma organização localizada em Sunrise, Flórida. Essa clínica particular supostamente injetou células-tronco nos globos oculares de três mulheres idosas. Essas mulheres estavam buscando alívio da degeneração macular. De acordo com o New England Journal of Medicine, o tratamento com células-tronco falhou e levou à cegueira nessas mulheres.
A perda visual grave dos pacientes após a injeção foi associada à hipertensão ocular, retinopatia hemorrágica, hemorragia vítrea, tração combinada e descolamento de retina regmatogênico ou luxação do cristalino.
Palavra para o sábio, quando se envolver em tratamentos experimentais e não comprovados…. mantê-lo fora de seus globos oculares.
Com toda a seriedade, se você está considerando um produto de terapia com células-tronco não aprovado pelo FDA,o FDA emitiu recomendações para ajudar a orientar a decisão do consumidor. Pergunte à clínica se o FDA emitiu um INDA (Investigational New Drug Application) para o tratamento. A presença de um INDA sinaliza que o FDA, pelo menos, começou a rever o tratamento. Se a clínica fornecer um número INDA, você poderá revisar as informações públicas por conta própria ou com seu médico. Se você estiver participando de uma terapia com células-tronco como participante de um ensaio clínico, solicite o folheto do pesquisador clínico. Essa brochura inclui informações sobre segurança e eficácia.
Conclusão…
- Clínicas de células-tronco agora estão localizadas por todo os EUA.
- A maioria dessas clínicas está operando fora dos regulamentos do FDA. Eles estão fazendo muito mais do que o processamento mínimo de tecido biológico antes do transplante. Eles também estão transplantando as células-tronco processadas em locais diferentes da área onde o tecido foi removido. Ambas as ações tornam o tratamento ilegítimo pelos regulamentos atuais do FDA.
- Na maior parte, o FDA está esperando três anos para começar a aplicar essas novas regulamentações.
Continuarei atualizando esta página à medida que o campo da ciência das células-tronco evoluir.
Continua…
Referências:
Abbott, A. “Behind the scenes of the world’s first commercial stem-cell therapy.” Nature. doi 10 (2015).
Evans, Martin J., and Matthew H. Kaufman. “Establishment in culture of pluripotential cells from mouse embryos.” nature292.5819 (1981): 154.
Hirsch, Tobias, et al. “Regeneration of the entire human epidermis using transgenic stem cells.” Nature 551.7680 (2017): 327.
Hwang, Woo Suk, et al. “Patient-specific embryonic stem cells derived from human SCNT blastocysts.” Science 308.5729 (2005): 1777-1783.
Kuriyan, Ajay E., et al. “Vision loss after intravitreal injection of autologous “stem cells” for AMD.” New England Journal of Medicine 376.11 (2017): 1047-1053.
Makkar, Raj R., et al. “Intracoronary cardiosphere-derived cells for heart regeneration after myocardial infarction (CADUCEUS): a prospective, randomised phase 1 trial.” The Lancet 379.9819 (2012): 895-904.
Schwartz, Steven D., et al. “Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies.” The Lancet385.9967 (2015): 509-516.
Sun, Jessica M., et al. “Effect of Autologous Cord Blood Infusion on Motor Function and Brain Connectivity in Young Children with Cerebral Palsy: A Randomized, Placebo‐Controlled Trial.” Stem cells translational medicine 6.12 (2017): 2071-2078.
Tachibana, Masahito, et al. “Human embryonic stem cells derived by somatic cell nuclear transfer.” Cell 153.6 (2013): 1228-1238.
Takahashi, Kazutoshi, et al. “Induction of pluripotent stem cells from adult human fibroblasts by defined factors.” cell 131.5 (2007): 861-872.
Turner, Leigh, and Paul Knoepfler. “Selling stem cells in the USA: assessing the direct-to-consumer industry.” Cell Stem Cell 19.2 (2016): 154-157.
Tsuji, Wakako, J. Peter Rubin, and Kacey G. Marra. “Adipose-derived stem cells: Implications in tissue regeneration.” World journal of stem cells 6.3 (2014): 312.
Zhu, Hua, et al. “Therapeutic Effects of Human Umbilical Cord-Derived Mesenchymal Stem Cells in Acute Lung Injury Mice.” Scientific reports 7 (2017): 39889.
Este artigo foi traduzido pela Retina Brasil. Acesse o original e acompanhe as atualizações.
Artigo original: https://www.risingtidebio.com/history-stem-cell-therapy-benefits/#history
Leia mais notícias sobre Pesquisas

Tratamento para Retinose Pigmentar derivado de células-tronco pluripotentes induzidas avança para o ensaio clínico
Está notícia foi traduzida pela Retina Brasil . Para acessar a matéria original, clique aqui Lembre-se de sempre consultar o seu médico oftalmologista, ele é o melhor

Doenças Hereditárias da Retina custam até $33 Bilhões anualmente às Economias dos EUA e do Canadá
Está notícia foi traduzida pela Retina Brasil . Para acessar a matéria original, clique aqui Lembre-se de sempre consultar o seu médico oftalmologista, ele é o

Tecnologia de vetor-duplo em pesquisa de terapia gência para a Doença de Stargardt
Está notícia foi traduzida pela Retina Brasil. Para acessar a matéria original, clique aqui. Lembre-se de sempre consultar o seu médico oftalmologista, ele é o

Pesquisa DMRI com atrofia geográfica
Pesquisa para pacientes com Degeneração Macular Relacionada à Idade (DMRI) com atrofia geográfica. Critérios: Acima de 60 anos DMRI Forma Seca com atrofia geográfica Sem
Leia mais sobre:
Sobre Nós
Sore a Retina Brasil. Nossa Missão e Trabalho.https://www.risingtidebio.com/history-stem-cell-therapy-benefits/#history
Doenças Raras e Hereditárias da Retina (DHRs)
Retinose Pigmentar, Doença de Stagardt, Síndrome de Usher, Amaurose Congênita de Leber, etc.
Doenças Comuns da Retina
Deheneração Macular Relacionada à Idade (DMRI), Retinopatia Diabética, Edema Macular Diabético.
Tecnologia Assistiva
Recursos de tecnologia assistiva, aplicativos, lupas, e outros recursos que ajudam as pessoas com deficiência visual, com Baixa Visão ou cegas.

