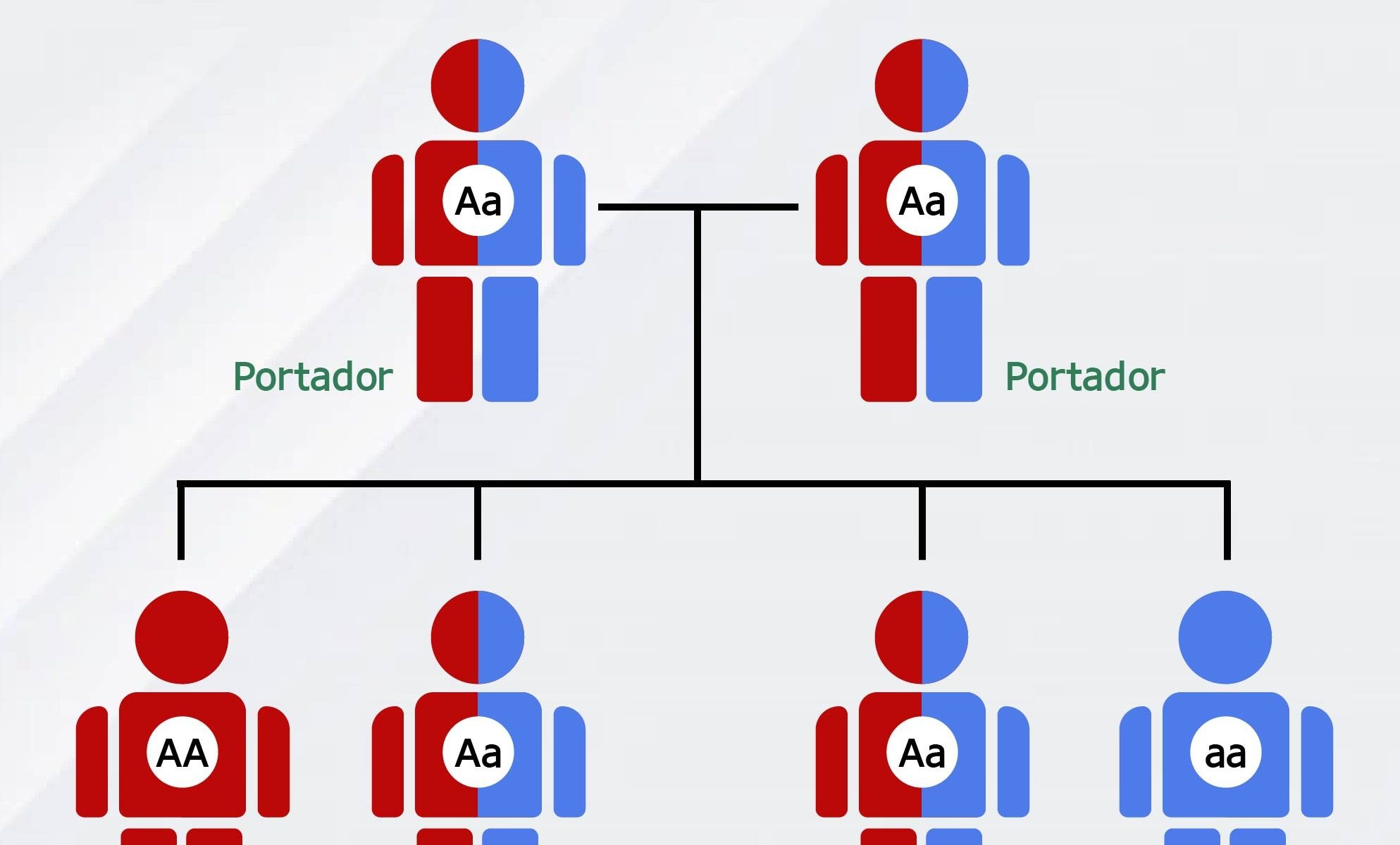
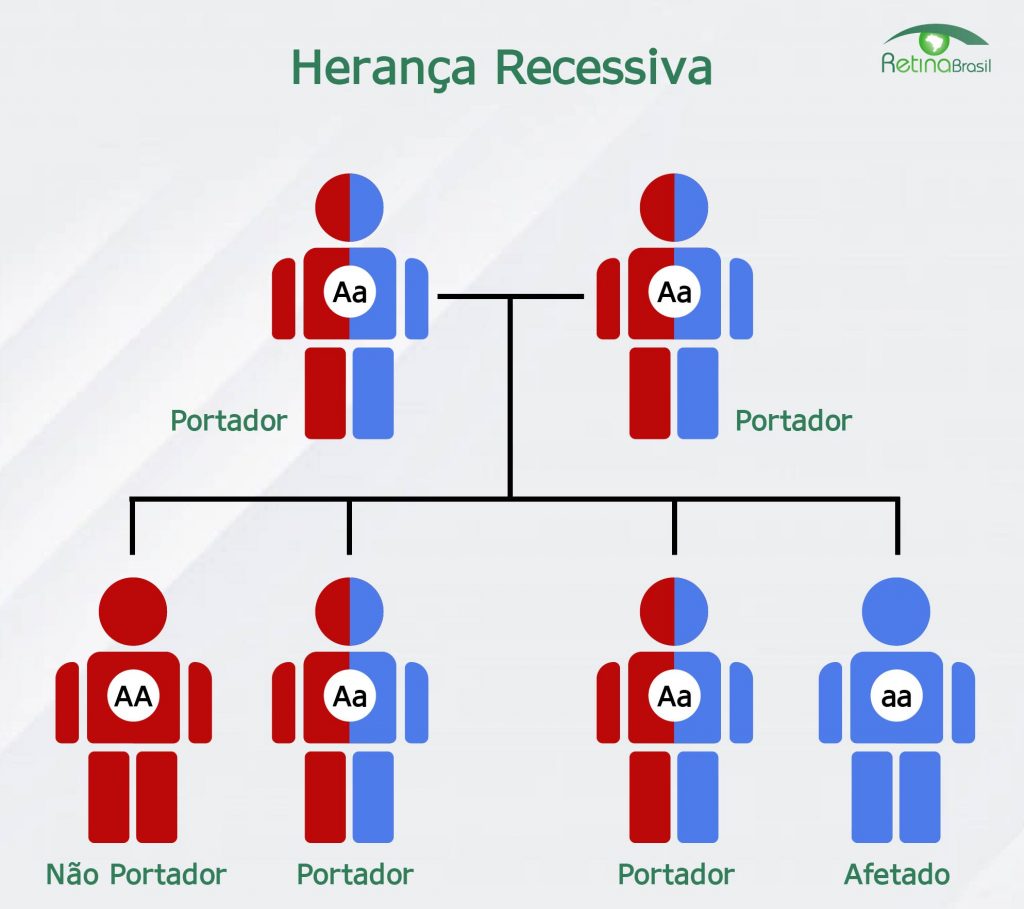
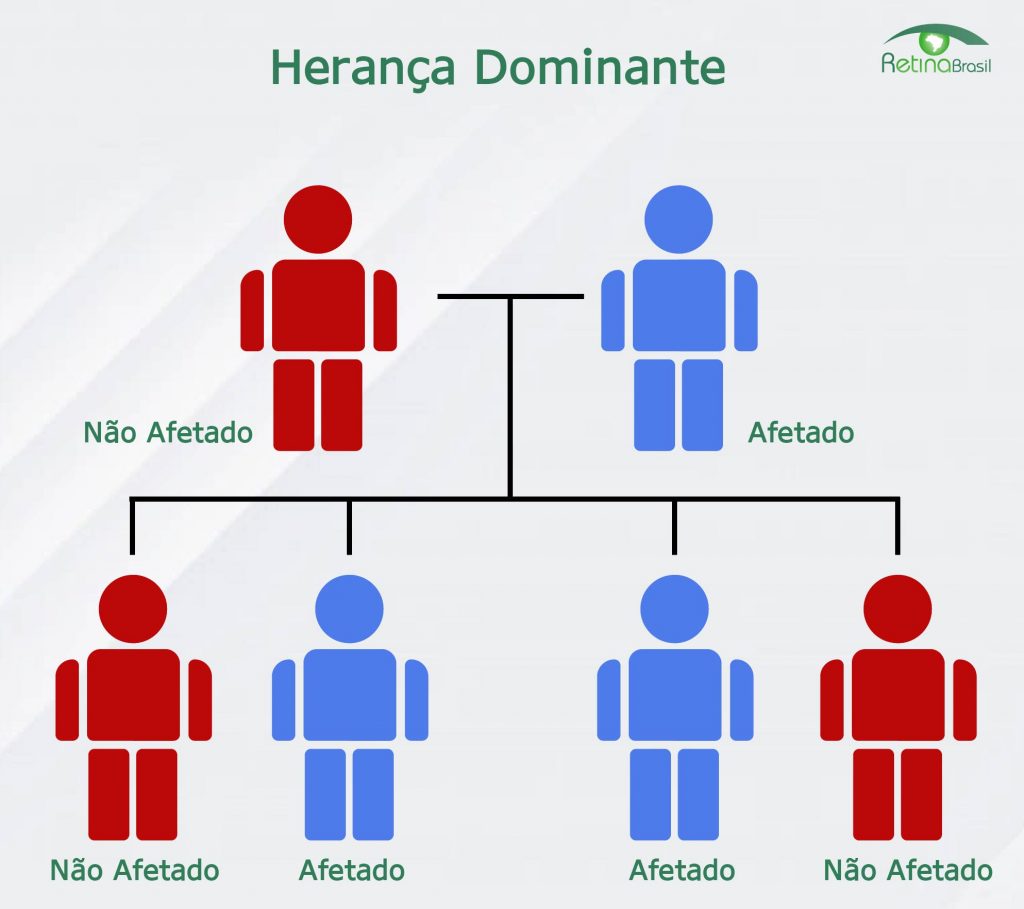
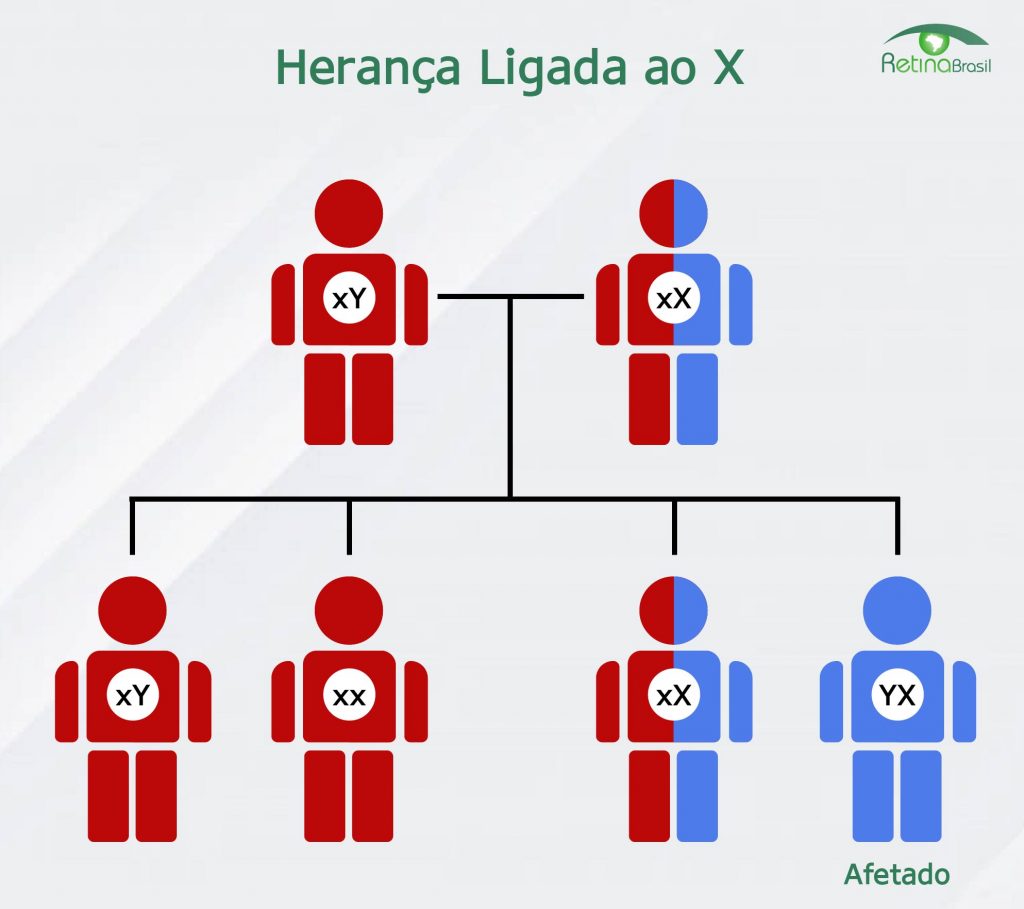
Está notícia foi traduzida pela Retina Brasil. Para acessar a matéria original, clique aqui. Lembre-se de sempre consultar o seu médico oftalmologista, ele é o melhor profissional para escalrecer as suas dúvidas sobre diagnóstico, tratamento e pesquisas.
A empresa AGTC anuncia seu segundo programa de pesquisa em oftalmologia pré-clínica para a Doença de Stargardt e publicada resultados pré-clínicos convincentes que sustentam o potencial de sua tecnologia de vetor duplo para tereapia gênica.
A entrega simultânea de dois vetores AAV otimizados expande o potencial terapêutico e comercial da plataforma AAV líder da indústria da AGTC, permitindo o fornecimento de DNA que codifica proteínas maiores.
Gainesville, Flórida e Cambridge, Massachutes; 05 de Novembro de 2019 (Globe Newswire) – A Applied Genetic Technologies Corporation (Nasdaq: AGTC), uma empresa de biotecnologia que realiza testes clínicos em humanos para terapias gênicas baseadas em vírus adeno-associados (AAV) para o tratamento de doenças raras, anunciou hoje que identificou a Doença de Stargardt como o segundo programa de oftalmologia em sua expansão pré clínica anunciada anteriormente, que também inclui um programa focado na forma seca da Degeneração Macular Relacionada à Idade (DMRI). A empresa está reportando dados de validação de conceito para sua candidata à terapia gênica da Doença de Stargardt em primatas não-humanos (PNH).
A Doença de Stargardt, a forma mais comum de degeneração macular hereditária, ocorre em 1 entre 8.000-10.000 indivíduos e, na maioria das vezes, resulta de mutações no gene ABCA4. A perda da proteína ABCA4 funcional leva ao acúmulo de substâncias tóxicas nas células fotorreceptoras, resultando na morte delas e também na perda progressiva da visão. Um desafio chave no desenvolvimento de uma terapia gênica baseada em AAV para o tratamento da Doença de Stargardt é que a sequência de DNA que codifica a proteína ABCA4 excede a capacidade de carga útil dos vetores AAV. O programa da AGTC para Doença de Stargardt aborda efetivamente esse desafio, dividindo a sequência de codificação em dois vetores AAV separados. Uma vez dentro da célula, os dois fragmentos de DNA se recombinam para formar a sequência de codificação completa, que produz a proteína ABCA4 funcional de comprimento total.
“A expansão de nosso pipeline pré-clínico para incluir a Doença de Stargardt e a DMRI seca demonstra a ampla utilidade terapêutica e comercial de nossa plataforma proprietária de fornecimento de genes AAV” disse Sue Washer, presidente e CEO da AGTC. “Nosso programa para Doença de Stargardt ressalta nossa capacidade de alavancar nossa expertise em vetor AAV e engenharia de genoma para expandir a terapia genética de AAV em novas indicações que exigem a entrega de cargas úteis de DNA maiores. A DMRI seca representa uma oportunidade de mercado muito atraente, uma vez que a doença afeta mais de 24 milhões de pessoas em todo o mundo. Cada um desses programas pré-clínicos baseia-se em nossas capacidades líderes do setor de terapia gênica para doenças da retina e eles irão alavancar nossa expertise em expansão no projeto e implementação de estudos pré-clínicos e clínicos que são otimizados para o sucesso.”
William Hauswirth, PhD, inovador líder em terapia gênica de AAV na Universidade da Flórida e colaborador acadêmico de longo prazo da AGTC, e seus colegas na Universidade de British Columbia, publicaram recentemente dados demonstrando que um sistema de vetor AAV duplo híbrido ABCA4 era seguro e proporcionava benefício terapêutico em um modelo de camundongo da Doença de Stargardt .1 Pesquisadores da AGTC otimizaram os vetores utilizados no estudo do Dr. Hauswirth para administração em PNHs. Em um estudo de 13 semanas, a injeção sub-retinal de AAVs preparados na AGTC que codificam o fragmento N-terminal e o fragmento C-terminal da proteína ABCA4 humana, que foram marcados para distinguir a proteína ABCA4 de primata não-humano de ocorrência natural, resultou na detecção clara da proteína ABCA4 humana recombinante de comprimento total. A proteína foi detectada em punções de tecido colhidas de dentro da bolha sub-retiniana, mas não no tecido circundante não tratado, confirmando a especificidade e eficácia da administração do vetor. Estes resultados em PNHs são um importante avanço técnico para o uso de sistemas de expressão de vetores AAV duplos na terapia gênica da retina. Com base nos resultados deste estudo, a AGTC está continuando o desenvolvimento terapêutico de seu sistema de vetor duplo otimizado para o tratamento da doença de Stargardt.
“Nossa publicação recente forneceu dados de validação de conceito importantes que apoiam a segurança e a utilidade terapêutica do uso de um sistema de vetor AAV duplo para fornecer e transmitir a proteína ABCA4” disse William W. Hauswirth, PhD, Professor de Oftalmologia e Maida e Morris Rybaczki Eminent Scholar Chair em Ciências Oftálmicas do Departamento de Oftalmologia da Universidade da Flórida. “A demonstração do AGTC de que esta abordagem é segura e resulta na expressão da proteína ABCA4 em PNHs após a injeção sub-retiniana de seus vetores otimizados é um marco importante no avanço da terapia genética para a Doença de Stargardt.”
Referência
1 Dyka FM, Molday LL, Chiodo VA, Molday RS e Hauswirth WW. O tratamento do vetor duplo ABCA4-AAV reduz o acúmulo de A2E retinal patogênico em um modelo de camundongo com doença de Stargardt autossômica recessiva. Human Gene Therapy. 30 de Setembro de 2019. Doi: 10.1089/hum.2019.132.
Leia mais notícias de Pesquisas
Veja outras Notícias
Sobre a AGTC
A AGTC é uma empresa de biotecnologia em estágio clínico que usa uma plataforma proprietária de terapia genética para desenvolver terapias gênicas transformacionais para pacientes que sofrem de doenças raras e debilitanes. Seu foco inicial está na área de oftalmologia, na qual possui ensaios clínicos ativos em Retinose Pigmentar relacionada ao X e Acromatopsia (ACHM CNGB3 & ACHM CNGA3). Além de seus ensaios clínicos, a AGTC tem programas pré-clínicos em optogenética, adrenoleucodistrofia (ALD), que é uma doença do sistema nervoso central (SNC), e outras indicações do SNC, oftalmologia e otologia. O programa de optogenética tem sido desenvolvido em colaboração com a Bionic Sight. Já o programa de otologia está sendo desenvolvido em parceria com a Otonomy. A AGTC tem um portfólio de propriedade intelectual significativo e ampla experiência no projeto de produtos de terapia genética, incluindo capsídes, promotores e cassetes de expressão, bem como expertise na formulação, fabricação e distribuição física de produtos de terapia genética.
Sobre a Retinose Pigmentar ligada ao X (do inglês, XLRP)
A XLRP é uma condição hereditária que causa perda progressiva da visão em meninos e homens jovens. As características da doença incluem cegueira noturna na primeira infância e diminuição progressiva do campo de visão. Em geral, os pacientes com XLRP vivenciam um declínio gradual na acuidade visual ao longo do curso da doença, o que resulta em cegueira legal por volta da 4ª década de vida. A AGTC recebeu a designação de medicamento órfão da FDA (Food and Drug Administration) dos EUA em 2017, bem como a mesma designação da Comissão Européia em 2016, por seu produto de terapia gênica candidato a tratar a XLRP causada por mutações no gene RPGR.
Sobre a Acromatopsia (ACHM)
A acromatopsia é uma doença hereditária da retina, que está presente desde o nascimento e é caracterizada pela falta de função dos fotorreceptores do tipo cone. A condição resulta em acuidade visual acentuadamente reduzida, extrema sensibilidade à luz causando cegueira diurna e perda completa da discriminação de cores. A acuidade visual melhor corrigida em pessoas afetadas pela acromatopsia, mesmo sob condições de pouca luz, é geralmente cerca de 20/200, um nível em que as pessoas são consideradas legalmente cegas.
Declarações Prospectivas
Este comunicado contém declarações prospectivas que refletem os planos, estimativas, suposições e crenças da AGTC. As declarações prospectivas incluem informações sobre resultados operacionais possíveis ou presumidos, orientação financeira, estratégias e operações de negócios, desenvolvimento de produtos pré-clínicos e clínicos, progresso regulatório, oportunidades de crescimento em potencial, oportunidades de mercado em potencial e os efeitos da concorrência. Declarações prospectivas incluem todas as declarações que não são fatos históricos e podem ser identificadas por termos como “antecipa”, “acredita”, “poderia”, “busca”, “estima”, “espera”, “pretende”, “pode”, “planeja”, “potencial”, prevê”, “projeta”, “deveria”, “irá”, “faria” ou expressões similares e as formas negativas destes termos. Os resultados reais podem diferir materialmente daqueles discutidos nas declarações prospectivas, devido a uma série de fatores importantes. Os riscos e incertezas que podem fazer os resultados reais diferirem materialmente incluem, entre outros: a terapia gênica ainda é nova, com apenas alguns tratamentos aprovados até agora; a AGTC não pode prever quando ou se obterá aprovação regulatória para comercializar um produto candidato ou receberá um reembolso razoável; incertezas inerentes aos ensaios clínicos e ao processo de revisão regulatória; riscos e incertezas associados ao desenvolvimento e comercialização de medicamentos; fatores que podem fazer com que os resultados reais difiram materialmente daqueles descritos nas declarações prospectivas são apresentados sob o título “Fatores de Risco” no Relatório Anual da empresa no formulário 10-K para o ano fiscal encerrado em 30 de Junho de 2019, arquivado com o SEC. Dadas essas incertezas, você não deve depositar confiança indevida nessas declarações prospectivas. Além disso, as declarações prospectivas representam os planos, estimativas, suposições e crenças da administração somente na data deste comunicado. Exceto o que é exigido por lei, não assumimos nenhuma obrigação de atualizar essas declarações prospectivas publicamente ou de atualizar as razões pelas quais os resultados reais podem diferir materialmente daqueles antecipados nessas declarações, mesmo se novas informações forem disponibilizadas no futuro.
Veja o artigo completo: https://health.einnews.com/pr_news/501241014/agtc-announces-stargardt-disease-as-its-second-preclinical-ophthalmology-program-and-reports-compelling-preclinical-data-supporting-the-potential-of?ref=rss&ecode=XA1gyJWn1gRoDHlD&utm_source=RSSNews&utm_medium=rss&utm_campaign=Vision+Loss+News&utm_content=article&fbclid=IwAR0ts2cL0j9tOxfkghNSQwFqy1qOto-7yp-xsBIVPf0b3c8UFum8OsIzA98